金屬腐蝕之電化學腐蝕的原理與防護
本文主要講述了金屬腐蝕的定義及分類,理解金屬腐蝕的化學原理,分清化學腐蝕與電化學腐蝕的區(qū)別和聯(lián)系,金屬防護的常用方法,以及防止金屬腐蝕的重要意義。

金屬的腐蝕現(xiàn)象非常普遍:
1、鋼鐵生銹: 鐵銹的主要成分: Fe2O3·XH2O
2、銅器表面生成銅綠: 銅綠的主要成分: Cu2(OH)2CO3
金屬腐蝕的危害有哪些?
中國航天工業(yè)總公司第三十一研究所近日公布了一組數(shù)據:
◆全球每一分鐘就有1噸鋼腐蝕成鐵銹.
◆全球每年鋼鐵腐蝕的經濟損失約100000億美元,占各國國民生產總值的2%~4%,我國鋼鐵腐蝕經濟損失高達2800億人民幣,約占國民生產總值的4%,每年約有30%的鋼鐵因腐蝕而報廢。腐蝕給人類造成的損失是驚人的。
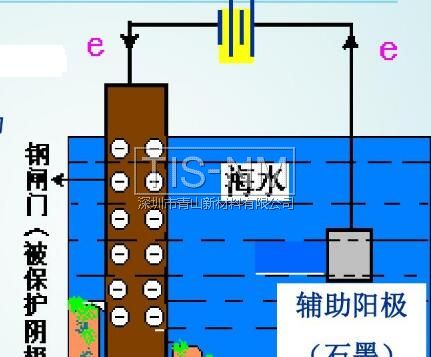
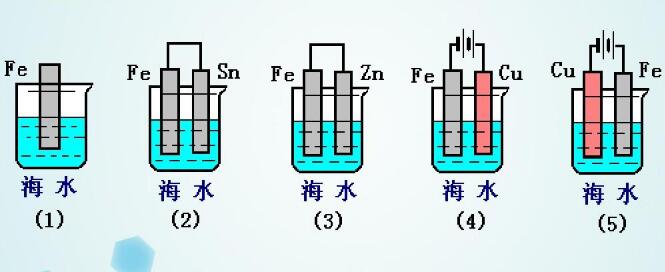
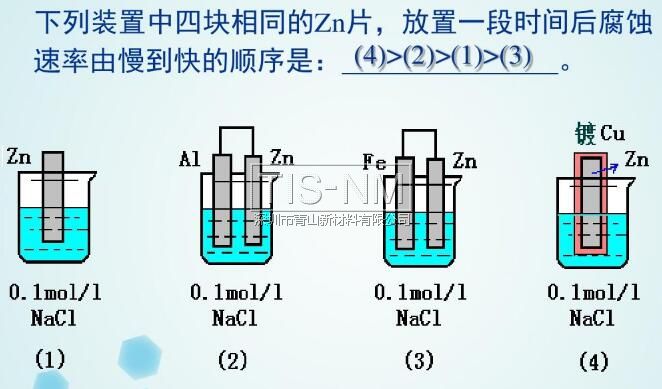
◆全世界每年因為金屬腐蝕造成的直接經濟損失約達7000億美元,是地震 一 1 指金屬或合金與周圍接觸到的氣體或液體進行化學反應而腐蝕損耗的過程。 2 是金屬本身失去電子變成陽離子的過程 (發(fā)生氧化反應)。 M - ne- = Mn+ 升溫可加速金屬腐蝕 潮濕的環(huán)境可促進金屬腐蝕 3 化學腐蝕: 金屬跟接觸到的干燥氣體(如SO2 電化學腐蝕:不純的金屬與電解質溶液接觸時 金屬的腐蝕以電化學腐蝕為主 電化學腐蝕 在潮濕的空氣里,鋼鐵表面吸附了一層薄薄的水膜 H2O + CO2 → H2CO3 → H+ + HCO3- H2O → H+ + OH- 這樣在鋼鐵表面形成了一層電解質溶液的薄膜,它跟鋼鐵里的鐵和少量的碳構成無數(shù)微小的原電池 析氫腐蝕 吸氧腐蝕 條件 水膜呈酸性 水膜呈堿性、中性或弱酸性 電極反應 負極 正極 總反應 Fe-2e-=Fe2+ 2H++2e-=H2↑ Fe+2H+=Fe2++H2↑ 2Fe-4e-=2Fe2+ O2+2H2O+4e-=4OH- 2Fe+2H2O+O2=2Fe(OH)2 4Fe(OH)2+2H2O+O2= 4Fe(OH)3 ↓ Fe2O3·nH2O(鐵銹) 聯(lián)系 通常以電化學腐蝕為主 二、金屬的防護 1、原理 防止金屬失電子 2 (1)犧牲陽極保護法 形成原電池反應時,負極材料很快被腐蝕 (2)外加電流的陰極保護法 將被保護金屬作為電解池的陰極,另一導電物質作為陽極 在同一電解質溶液中,金屬腐蝕的快慢: 電解池的陽極 > 原電池的負極 > 化學腐蝕 > 原電池的正極 > 電解池的陰極 防腐措施由好到壞的順序如下: 外接電源的陰極保護法 > 犧牲陽極的陰極保護法 > 有一般防腐條件保護 > 無防腐條件 以Fe片為例,不同的防腐措施下腐蝕變化速度是不同的: Fe片腐蝕由快到慢的順序 3 (1)在金屬表面覆蓋保護層。 例如:噴涂漆;涂油脂;表面鈍化;電鍍(在鋼鐵表面形成鉻等耐腐蝕性較強的金屬鍍層)等 (2)改變金屬內部的組成結構 在鋼鐵中加入一定比例的鉻和鎳 比如自行車車身部件通常都采用了以下的防腐措施: Zn片在不同防護措施下的腐蝕速度對比

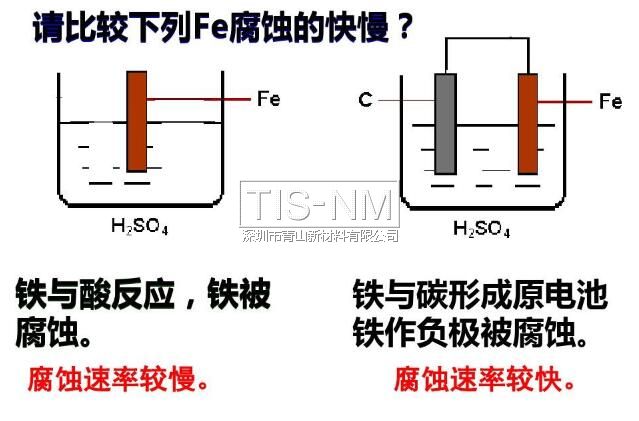

 鋼鐵的析氫腐蝕和吸氧腐蝕比較
鋼鐵的析氫腐蝕和吸氧腐蝕比較